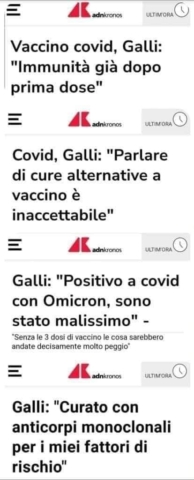
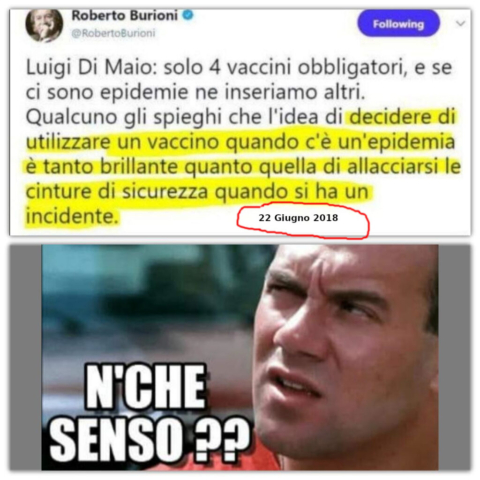
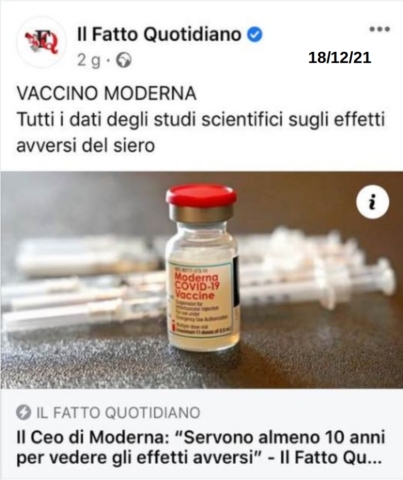
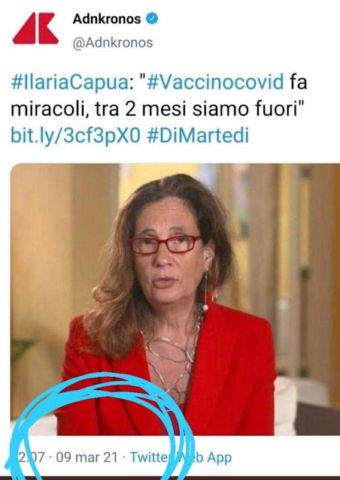
Dati aperti su vaccini e farmaci: adesso li chiedono anche i ricercatori italiani

di Terra Nuova
Il nodo italiano della collaborazione Cochrane si associa all’appello del British Medical Journal affinché i dati «grezzi» siano accessibili a tutti. Sul BMJ era apparso un editoriale in proposito, firmato da Peter Doshi, Fiona Godlee e Kamran Abbasi. Si legge nella nota dell’associazione: «La comunità scientifica deve poter accedere ai dati individuali degli studi su vaccini e trattamenti per Covid-19 per condurre analisi indipendenti, revisioni e metanalisi». 31 Gennaio 2022 234 letture covid-19
L’Associazione Alessandro Liberati – Cochrane Affiliate Centre (AssociALi) si unisce all’appello del British Medical Journal per una maggiore trasparenza da parte di aziende e agenzie regolatorie. «La comunità scientifica deve poter accedere ai dati individuali degli studi su vaccini e trattamenti per Covid-19 per condurre analisi indipendenti, revisioni e metanalisi» si legge nella nota.
Riprtiamo alcuni passaggi che si leggono sul sito dell’associazione:
«”Abbiamo bisogno di una completa trasparenza dei dati per tutti gli studi, ne abbiamo bisogno nell’interesse pubblico e ne abbiamo bisogno ora”. Si conclude con queste parole un editoriale pubblicato qualche giorno fa sul British Medical Journal a firma di Peter Doshi, Fiona Godlee e Kamran Abbasi in cui in tre editor chiedono che i dati clinici individuali (i cosiddetti dati grezzi o raw data) degli studi sui vaccini e sui trattamenti per Covid-19 siano messi a disposizione della comunità scientifica. Un appello, questo, a cui si unisce anche l’Associazione Alessandro Liberati – Cochrane Affiliate Centre (AssociALi)» .
«Al momento i dati riguardanti i singoli individui che hanno preso parte agli studi non sono accessibili ai medici, ai ricercatori e al pubblico. A essere pubblicati sulle riviste scientifiche sono infatti i risultati delle analisi statistiche condotte su quei dati, mentre le informazioni relative ai singoli partecipanti – le quali potrebbero essere utilizzate per studi indipendenti, revisioni e metanalisi – restano per anni ad accesso esclusivo dell’azienda produttrice e delle agenzie regolatorie. “È questo il tempo di chiedere i dati grezzi, ma è di fatto anche il tempo della necessaria crescita/imposizione del rigore scientifico, della trasparenza e della metodologia Cochrane (quindi la completezza e la ripetibilità del metodo)”, ha commentato Maria Grazia Celani, Presidente di AssociALi. “Ma è un circolo vizioso perché con pochi dati o con dati selezionati le revisioni sono spazzatura. Trusted evidence, informed decisions, e better health dovrebbero rappresentare uno strumento unico e diffuso utilizzato dalle agenzie regolatorie ma anche da società scientifiche, università, riviste internazionali e nel corso di discussioni di esperti”».
«Per quanto riguarda i vaccini per Covid-19 i dati grezzi potrebbero non essere accessibili per diverso tempo – si legge ancora – Pfizer, ad esempio, ha dichiarato che comincerà ad accogliere le richieste di rilascio dei dati sul suo vaccino anti-Covid-19 solo a partire da maggio 2025, quando saranno passati due anni dalla data prevista di completamento dello studio primario. Moderna ha comunicato che i dati “potrebbero essere disponibili (…) con la pubblicazione dei risultati finali dello studio”, la cui conclusione è stimata per il 27 ottobre 2022. Sul sito di AstraZeneca si legge invece che l’azienda è pronta a prendere in considerazione le richieste di accesso ai dati per i loro studi di fase III ma che le tempistiche per il rilascio “variano a seconda della richiesta e possono richiedere fino a un anno dalla presentazione completa della richiesta stessa”».
«I dati relativi alle terapie contro Covid-19, poi, sono altrettanto difficili da trovare – si legge ancora, tra le altre cose, nello scritto – Come riportano Doshi, Godlee e Abbasi, l’azienda Regeneron ha dichiarato che la condivisione dei dati relativi al trial di fase III della terapia a base di anticorpi monoclonali REGEN-COV sarà presa in considerazione solo nel momento in cui il trattamento dovesse essere approvato (e non solo autorizzato in caso di emergenza). Per il remdesivir invece gli US National Institutes of Health, che hanno finanziato la ricerca, hanno creato un nuovo portale per la condivisione dei dati ma le informazioni offerte, scrivono i tre editor del BMJ, sono piuttosto limitate».
«Tra le autorità regolatorie, invece, la Food and Drug Administration (FDA) degli Stati Uniti è quella che riceve la maggior parte dei dati ma tende a non rilasciarli. In seguito a una richiesta di accesso ai dati sul vaccino Pfizer, ad esempio, l’FDA ha acconsentito a condividere solo 500 pagine al mese sostenendo che la lentezza del processo, che avrebbe richiesto decenni per essere completato, è dovuta alla necessità di controllare le informazioni sensibili. Anche cercando di ottenere i dataset grezzi dall’Health Canada e dall’European Medicines Agency (EMA), tuttavia, si finisce per ottenere ben poco perché le due agenzie non ricevono o analizzano questo tipo di informazioni. Da qui la richiesta del British Medical Journal di rendere accessibili in modo completo e immediato i dati individuali dei vaccini e dei trattamenti per Covid-19. “La trasparenza – scrivono i tre autori dell’editoriale – è la chiave per costruire la fiducia e un modo importante per rispondere alle domande legittime dei cittadini sull’efficacia e la sicurezza dei vaccini e dei trattamenti e sulle politiche cliniche e di salute pubblica stabilite per il loro uso”. “Dovrebbero e potrebbero poi acquisire importanza i cittadini – ha aggiunto Celani – utili ad aiutare a divulgare i risultati evidenziando rischi e benefici, costi e quindi incertezza di efficacia, di durata e di applicabilità nelle diverse organizzazioni sociosanitarie”».
Pubblicato il 31/01/2022 su: